Energy Storage Chemical and Hydrogen
Penyimpanan Energi
Penyimpanan energi adalah suatu metode atau alat untuk menyimpan beberapa bentuk energi yang bisa diambil pada suatu waktu tertentu untuk berbagai kepentingan. Alat yang digunakan untuk menyimpan energi kadang-kadang disebut dengan akumulator. Semua bentuk energi yang termasuk ke dalam energi potensial (misal: energi kimia, energi listrik, dan sebagainya) atau energi termal dapat disimpan. Jam putar mekanis menyimpan energi potensial dalam tegangan mekanis. Baterai menyimpan energi kimia yang dapat diubah secara langsung menjadi energi listrik dengan menghubungkan kedua kutubnya dengan peralatan listrik. Bendungan hidroelektrik menyimpan energi dengan reservoir air sebagai energi potensial gravitasi. Makanan juga merupakan media penyimpanan energi, yaitu energi kimia, bahkan es dapat dikatakan sebagai sarana penyimpanan energi termal dan akan dipergunakan ketika kebutuhan akan temperatur dingin dibutuhkan.
Penyimpanan Energi Kimia
Bagian dari ilmu kimia yang mempelajari perubahan kalor atau panas suatu zat yang menyertai suatu reaksi atau proses kimia dan fisika disebut termokimia. secara operasional termokimia berkaitan dengan pengukuran dan pernafsiran perubahan kalor yang menyertai reaksi kimia, perubahan keadaan, dan pembentukan larutan. Termokimia merupakan pengetahuan dasar yang perlu diberikan atau yang dapat diperoleh dari reaksi-reaksi kimia, tetapi juga perlu sebagai pengetahuan dasar untuk pengkajian teori ikatan kimia dan struktur kimia. Fokus bahasan dalam termokimia adalah tentang jumlah kalor yang dapat dihasilkan oleh sejumlah tertentu pereaksi serta cara pengukuran kalor reaksi.
Untuk mengerti termokimia, perlu dipahami konsep sistem dan lingkungan. Sistem adalah suatu reaksi atau tempat yang dijadikan titik pusat perhatian. Lingkungan adalah semua hal yang menunjang sistem, atau dengan kata lain, semua hal di luar sistem. Contohnya, bila kita melihat segelas air, maka segelas air adalah sistem, sementara ruangan dan semua lainnya adalah lingkungan.
Ada 3 jenis sistem, berdasarkan transformasi materi dan energinya, yaitu:
1) Sistem terbuka, yaitu sistem dimana pertukaran materi dan energi keluar masuk sistem dapat dilakukan. Contohnya, air dalam gelas terbuka.
2) Sistem tertutup, dimana hanya ada pertukaran energi atau materi satu arah. Contohnya, air panas dalam gelas tertutup, dimana hanya panas (energi) dari dalam gelas yang bergerak ke arah lingkungan.
3) Sistem terisolasi, yaitu dimana tidak terjadi pertukaran materi dan energi sama sekali. Contohnya, air dalam termos.
Entalpi adalah kandungan energi pada suatu benda. Jika kita bayangkan kita melihat sebuah ember yang kita tidak tahu volumenya dan berisi air. Seperti banyak air yang tidak kita tahu, besar entalpi juga tidak kita ketahui. Namun, jika dari ambil atau beri air sebanyak satu gayung dari/pada ember tersebut, kita tahu perubahan isinya. Begitulah kita tahu perubahan entalpi. Entalpi dilambangkan dengan huruf H (terkadang dengan h). Kita dapat mengetahui perubahan entalpi pada suatu reaksi dengan:
ΔH = Hproduk - Hreaktan
dimana semuanya terdapat dalam satuan J atau kal. Jika kita hubungkan entalpi dengan hukum termodinamika yang pertama, kita akan tahu bahwa entalpi secara global tidak pernah berubah. Energi hanya bergerak, namun tidak bertambah atau berkurang.
Suatu reaksi dapat terjadi bila antar zat-zat yang terlibat reaksi saling bertumbukan namun tidak semua tumbukan tersebut menghasilkan reaksi, sebab partikel-partikel yang bertumbukan harus mempunyai energi yang cukup untuk memutuskan ikatan-ikatan. Energi Aktivasi (Ea) adalah adalah energi minimum yang diperlukan untuk melangsungkan terjadinya suatu reaksi. Contohnya dalam reaksi endoterm dan eksoterm di bawah ini.
Reaksi endoterm adalah kejadian dimana panas diserap oleh sistem dari lingkungan. Maka, ΔH > 0 dan suhu sekitarnya turun.
Ciri – ciri dari reaksi endoterm adalah reaksi yang membutuhkan atau memerlukan kalor, kalor mengalir dari lingkungan ke sistem, dan reaksi terjadi karena ΔH zat-zat yang bereaksi lebih kecil dari ΔH zat-zat hasil reaksi.
Reaksi eksoterm, adalah kejadian dimana panas mengalir dari sistem ke lingkungan. Maka, ΔH < O dan suhu produk akan lebih kecil dari reaktan. Ciri lain, suhu sekitarnya akan lebih tinggi dari suhu awal.
Berikut dibawah ini adalah gambar grafik perbandingan dari reaksi endoterm dan eksoterm.
Jadi baik dalam reaksi endoterm (menyerap kalor) maupun eksoterm (melepas kalor) tetap butuh energi aktivasi. Semakin rendah energi aktivasinya maka semakin mudah reksi dapat berlangsung. Jika partikel-partikel bertumbukan dengan energi yang lebih rendah dari energi aktivasi, maka tidak akan terjadi reaksi. Mereka akan kembali ke keadaan semula. Bayangkanlah energi aktivasi sebagai tembok dari reaksi. Hanya tumbukan yang memiliki energi sama atau lebih besar dari aktivasi energi yang dapat menghasilkan terjadinya reaksi.
Di dalam reaksi kimia, untuk mencerai-beraikan ikatan kimia dibutuhkan energi dan untuk membentuk ikatan-ikatan baru dilepaskan energi. Umumnya, ikatan-ikatan harus diceraikan sebelum ikatan-ikatan yang baru terbentuk. Maka baik dalam reaksi endoterm maupun eksoterm tetap dibutuhkan energi untuk mencerai-beraikan ikatan-ikatan kimia untuk memulai terjadinya suatu reaksi. Energi yang dibutuhkan inilah yang disebut sebagai energi aktivasi (Ea). Ketika tumbukan-tumbukan tersebut relatif lemah, dan tidak cukup energi untuk memulai proses penceraian ikatan. Hal ini mengakibatkan partikel-partikel tersebut tidak bereaksi.
Termokimia merupakan penerapan hukum pertama termodinamika terhadap peristiwa kimia yang membahas tentang kalor yang menyertai reaksi kimia. Termodinamika kimia dapat didefenisikan sebagai cabang kimia yang menangani hubungan kalor, kerja dan bentuk lain energi, dengan kesetimbangan dalam reaksi kimia dan dalam perubahan keadaan. Sebagian besar ciri-ciri dalam termokimia berkembang dari penerapan hukum termodinamika I, atau Hukum Kekekalan Energi, dialah Wilard Gibs, pendiri Termodinamika Pertama. Bunyi hukum Kekekalan Energi tersebut adalah, “Energi tidak dapat diciptakan atau dimusnahkan, tetapi dapat diubah dari satu bentuk ke bentuk yang lain, atau energi alam semesta adalah konstan.”.
Penyimpanan Energi Hydrogen
Energi kimia sebenarnya merupakan energi yang tersimpan dan merupakan bentuk yang kompak dari energi tersimpan seperti dapat dilihat dari Tabel 2.1. Selain baterai, bentuk energi kimia tersimpan yang bisa diharapkan terutama halnya produksi elemen atau molekul hydrogen. Banyak orang percaya sesudah bahan bakar minyak habis, umat manusia akan memakai hydrogen atau elektrik-hidrogen. Hidrogen merupakan bahan bakar yang sangat baik karena hasil pembakaran utamanya berbentuk air dan hydrogen dapat diambil lagi dari air dengan menggunakan sumber energi lain.
Hidrogen dapat disimpan dengan beberapa cara, dan sistem untuk memproduksi dan menyimpannya telah dikembangkan dengan baik. Hidrogen dapat disimpan sebagai gas tekenan tinggi, sebagai cairan pada temperatur cryogenic, atau dapat disimpan dalam bentuk metal-hidrida. Gas hidrogen mempunyai kerapatan yang sangat rendah sehingga untuk mewadahi energi yang memadai diperlukan volume yang sangat tinggi. Pencairan hidrogen memerlukan lebih banyak energi dan menambah biaya produksi sekitar 30%. Penyimpanan hidrogen dalam metal-hidrida mengakibatkan penambahan berat yang basar dan kehilangan panas serta masalah pengotoran oleh oksigen dan/atau air sehingga sangat mengurangi kemampuan penyimpanan energi.
Hidrogen dapat diproduksi dari bermacam-macam reaksi kimia yang berbeda. Reaksi yang mungkin paling dikenal ialah elektrolisa, dimana suatu arus searah dialirkan melalui konduktor air yang menghasilkan hydrogen di satu elektroda dan oksigen di elektroda yang lain. Proses elektrolisa mempunyai efisiensi konversi actual sekitar 85%. Tetapi karena proses ini menggunakan listrik, total efisiensi mulai dari energi panas, energi listrik sampai menjadi energi kimia maksimum hanya sekitar 35%. Karena hidrogen dapat diproduksi jauh lebih mudah dan lebih efisien dari bahan bakar fosil, produksi elektrolisa hanya digunakan jika dibutuhkan hidrogen yang sangat murni atau bila digunakan energi bahan bakar non fosil yang tidak mahal.
Kebanyakan hidrogen yang diproduksi pada waktu ini dibuat dari metana di dalam proses reformasi-uap pada suhu 900°C. Sistem ini menggunakan gas metana dalam reaksi berikut :
CH4 + H2O 3H2 + CO
reaksi ini merupakan merupakan reaksi endotermis yang membutuhkan sekitar 230 kJ/mol CH4. Karbon monoksida yang terbentuk dalam reaksi di atas kemudian digunakan untuk membentuk hidrogen tambahan dalam raeaksi berikut pada 400°C.
CO + H2O H2 + CO2
Karbon dioksida kemudian dikeluarkan dari gas bakar dengan menggunakan alkali atau amina dan kemudian di buang.
Cara lain untuk memproduksi hydrogen adalah mereaksikan uap air dengan naphtha, minyak berat atau bahkan kokas, batubara, dan batubara muda. Dalam suatu kilang minyak, sejumlah hidrogen dihasilkan dari perubahan nafta (C8H16) menjadi senyawa aromatic. Hidrogen terbentuk ketika terjadi pembentukan xylena (C8H10) :
C6H16 C8H10 + 3 H2
Hidrogen juga dapat dibentuk dalam proses uap air-besi, di mana uap air direaksikan dengan bed ferro oksida (FeO) panas (900°C). Dari reaksi ini dihasilkan besi oksida magnetik dan dan hidogen beserta panas 71 kJ/mol H2.
H2O + 3FeO Fe3O4 + H2
Bed diregeransi dengan melewatkan gas buang yang diperoleh dari pembakaran bahan bakar dengan udara yang kurang. Karbon monoksida dalam gas mereduksi Fe3O4 menjadi FeO.
Banyak penelitian telah dilaksanakan terhadap kemungkinan pembuatan hydrogen dengan apa yang disebut proses pemisahan air termokimia. Dalam proses ini air dipisah menjadi hydrogen dan oksigen dalam serangkaian siklus reaksi kimia tertutup yang beroperasi pada temperature yang berbeda. Kecuali bila terjadi lompatan kemajuan, nampaknya proses ini tidak akan kompetitif sampai bahan bakar fosil berkurang dan menjadi mahal.
Air dipecah menjadi hydrogen dan oksigen dengan radiasi ionisasi seperti di dapatkan dalam inti reactor nuklir. Cara ini tidak dipakai dalam pembuatan hidrogen karena sangat tidak efisien. Juga reaksi ini menimbulkan banyak masalah dalam operasi reactor air-ringan dan makin mengecilkan hati karena banyaknya inhibitor yang harus ditambahkan.
Penyimpanan energi adalah suatu metode atau alat untuk menyimpan beberapa bentuk energi yang bisa diambil pada suatu waktu tertentu untuk berbagai kepentingan. Alat yang digunakan untuk menyimpan energi kadang-kadang disebut dengan akumulator. Semua bentuk energi yang termasuk ke dalam energi potensial (misal: energi kimia, energi listrik, dan sebagainya) atau energi termal dapat disimpan. Jam putar mekanis menyimpan energi potensial dalam tegangan mekanis. Baterai menyimpan energi kimia yang dapat diubah secara langsung menjadi energi listrik dengan menghubungkan kedua kutubnya dengan peralatan listrik. Bendungan hidroelektrik menyimpan energi dengan reservoir air sebagai energi potensial gravitasi. Makanan juga merupakan media penyimpanan energi, yaitu energi kimia, bahkan es dapat dikatakan sebagai sarana penyimpanan energi termal dan akan dipergunakan ketika kebutuhan akan temperatur dingin dibutuhkan.
Penyimpanan Energi Kimia
Bagian dari ilmu kimia yang mempelajari perubahan kalor atau panas suatu zat yang menyertai suatu reaksi atau proses kimia dan fisika disebut termokimia. secara operasional termokimia berkaitan dengan pengukuran dan pernafsiran perubahan kalor yang menyertai reaksi kimia, perubahan keadaan, dan pembentukan larutan. Termokimia merupakan pengetahuan dasar yang perlu diberikan atau yang dapat diperoleh dari reaksi-reaksi kimia, tetapi juga perlu sebagai pengetahuan dasar untuk pengkajian teori ikatan kimia dan struktur kimia. Fokus bahasan dalam termokimia adalah tentang jumlah kalor yang dapat dihasilkan oleh sejumlah tertentu pereaksi serta cara pengukuran kalor reaksi.
Untuk mengerti termokimia, perlu dipahami konsep sistem dan lingkungan. Sistem adalah suatu reaksi atau tempat yang dijadikan titik pusat perhatian. Lingkungan adalah semua hal yang menunjang sistem, atau dengan kata lain, semua hal di luar sistem. Contohnya, bila kita melihat segelas air, maka segelas air adalah sistem, sementara ruangan dan semua lainnya adalah lingkungan.
Ada 3 jenis sistem, berdasarkan transformasi materi dan energinya, yaitu:
1) Sistem terbuka, yaitu sistem dimana pertukaran materi dan energi keluar masuk sistem dapat dilakukan. Contohnya, air dalam gelas terbuka.
2) Sistem tertutup, dimana hanya ada pertukaran energi atau materi satu arah. Contohnya, air panas dalam gelas tertutup, dimana hanya panas (energi) dari dalam gelas yang bergerak ke arah lingkungan.
3) Sistem terisolasi, yaitu dimana tidak terjadi pertukaran materi dan energi sama sekali. Contohnya, air dalam termos.
Entalpi adalah kandungan energi pada suatu benda. Jika kita bayangkan kita melihat sebuah ember yang kita tidak tahu volumenya dan berisi air. Seperti banyak air yang tidak kita tahu, besar entalpi juga tidak kita ketahui. Namun, jika dari ambil atau beri air sebanyak satu gayung dari/pada ember tersebut, kita tahu perubahan isinya. Begitulah kita tahu perubahan entalpi. Entalpi dilambangkan dengan huruf H (terkadang dengan h). Kita dapat mengetahui perubahan entalpi pada suatu reaksi dengan:
ΔH = Hproduk - Hreaktan
dimana semuanya terdapat dalam satuan J atau kal. Jika kita hubungkan entalpi dengan hukum termodinamika yang pertama, kita akan tahu bahwa entalpi secara global tidak pernah berubah. Energi hanya bergerak, namun tidak bertambah atau berkurang.
Suatu reaksi dapat terjadi bila antar zat-zat yang terlibat reaksi saling bertumbukan namun tidak semua tumbukan tersebut menghasilkan reaksi, sebab partikel-partikel yang bertumbukan harus mempunyai energi yang cukup untuk memutuskan ikatan-ikatan. Energi Aktivasi (Ea) adalah adalah energi minimum yang diperlukan untuk melangsungkan terjadinya suatu reaksi. Contohnya dalam reaksi endoterm dan eksoterm di bawah ini.
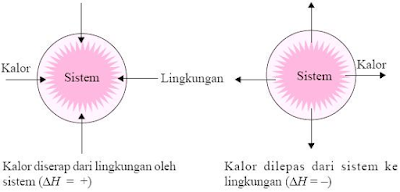
Reaksi endoterm adalah kejadian dimana panas diserap oleh sistem dari lingkungan. Maka, ΔH > 0 dan suhu sekitarnya turun.
Gambar
1 Reaksi Endoterm
Ciri – ciri dari reaksi endoterm adalah reaksi yang membutuhkan atau memerlukan kalor, kalor mengalir dari lingkungan ke sistem, dan reaksi terjadi karena ΔH zat-zat yang bereaksi lebih kecil dari ΔH zat-zat hasil reaksi.
Reaksi eksoterm, adalah kejadian dimana panas mengalir dari sistem ke lingkungan. Maka, ΔH < O dan suhu produk akan lebih kecil dari reaktan. Ciri lain, suhu sekitarnya akan lebih tinggi dari suhu awal.
Gambar
2 Reaksi Eksoterm
Berikut dibawah ini adalah gambar grafik perbandingan dari reaksi endoterm dan eksoterm.
Gambar 3 Grafik Reaksi Eksoterm dan Endoterm
Jadi baik dalam reaksi endoterm (menyerap kalor) maupun eksoterm (melepas kalor) tetap butuh energi aktivasi. Semakin rendah energi aktivasinya maka semakin mudah reksi dapat berlangsung. Jika partikel-partikel bertumbukan dengan energi yang lebih rendah dari energi aktivasi, maka tidak akan terjadi reaksi. Mereka akan kembali ke keadaan semula. Bayangkanlah energi aktivasi sebagai tembok dari reaksi. Hanya tumbukan yang memiliki energi sama atau lebih besar dari aktivasi energi yang dapat menghasilkan terjadinya reaksi.
Di dalam reaksi kimia, untuk mencerai-beraikan ikatan kimia dibutuhkan energi dan untuk membentuk ikatan-ikatan baru dilepaskan energi. Umumnya, ikatan-ikatan harus diceraikan sebelum ikatan-ikatan yang baru terbentuk. Maka baik dalam reaksi endoterm maupun eksoterm tetap dibutuhkan energi untuk mencerai-beraikan ikatan-ikatan kimia untuk memulai terjadinya suatu reaksi. Energi yang dibutuhkan inilah yang disebut sebagai energi aktivasi (Ea). Ketika tumbukan-tumbukan tersebut relatif lemah, dan tidak cukup energi untuk memulai proses penceraian ikatan. Hal ini mengakibatkan partikel-partikel tersebut tidak bereaksi.
Termokimia merupakan penerapan hukum pertama termodinamika terhadap peristiwa kimia yang membahas tentang kalor yang menyertai reaksi kimia. Termodinamika kimia dapat didefenisikan sebagai cabang kimia yang menangani hubungan kalor, kerja dan bentuk lain energi, dengan kesetimbangan dalam reaksi kimia dan dalam perubahan keadaan. Sebagian besar ciri-ciri dalam termokimia berkembang dari penerapan hukum termodinamika I, atau Hukum Kekekalan Energi, dialah Wilard Gibs, pendiri Termodinamika Pertama. Bunyi hukum Kekekalan Energi tersebut adalah, “Energi tidak dapat diciptakan atau dimusnahkan, tetapi dapat diubah dari satu bentuk ke bentuk yang lain, atau energi alam semesta adalah konstan.”.
Penyimpanan Energi Hydrogen
Energi kimia sebenarnya merupakan energi yang tersimpan dan merupakan bentuk yang kompak dari energi tersimpan seperti dapat dilihat dari Tabel 2.1. Selain baterai, bentuk energi kimia tersimpan yang bisa diharapkan terutama halnya produksi elemen atau molekul hydrogen. Banyak orang percaya sesudah bahan bakar minyak habis, umat manusia akan memakai hydrogen atau elektrik-hidrogen. Hidrogen merupakan bahan bakar yang sangat baik karena hasil pembakaran utamanya berbentuk air dan hydrogen dapat diambil lagi dari air dengan menggunakan sumber energi lain.
Hidrogen dapat disimpan dengan beberapa cara, dan sistem untuk memproduksi dan menyimpannya telah dikembangkan dengan baik. Hidrogen dapat disimpan sebagai gas tekenan tinggi, sebagai cairan pada temperatur cryogenic, atau dapat disimpan dalam bentuk metal-hidrida. Gas hidrogen mempunyai kerapatan yang sangat rendah sehingga untuk mewadahi energi yang memadai diperlukan volume yang sangat tinggi. Pencairan hidrogen memerlukan lebih banyak energi dan menambah biaya produksi sekitar 30%. Penyimpanan hidrogen dalam metal-hidrida mengakibatkan penambahan berat yang basar dan kehilangan panas serta masalah pengotoran oleh oksigen dan/atau air sehingga sangat mengurangi kemampuan penyimpanan energi.
Hidrogen dapat diproduksi dari bermacam-macam reaksi kimia yang berbeda. Reaksi yang mungkin paling dikenal ialah elektrolisa, dimana suatu arus searah dialirkan melalui konduktor air yang menghasilkan hydrogen di satu elektroda dan oksigen di elektroda yang lain. Proses elektrolisa mempunyai efisiensi konversi actual sekitar 85%. Tetapi karena proses ini menggunakan listrik, total efisiensi mulai dari energi panas, energi listrik sampai menjadi energi kimia maksimum hanya sekitar 35%. Karena hidrogen dapat diproduksi jauh lebih mudah dan lebih efisien dari bahan bakar fosil, produksi elektrolisa hanya digunakan jika dibutuhkan hidrogen yang sangat murni atau bila digunakan energi bahan bakar non fosil yang tidak mahal.
Kebanyakan hidrogen yang diproduksi pada waktu ini dibuat dari metana di dalam proses reformasi-uap pada suhu 900°C. Sistem ini menggunakan gas metana dalam reaksi berikut :
CH4 + H2O 3H2 + CO
reaksi ini merupakan merupakan reaksi endotermis yang membutuhkan sekitar 230 kJ/mol CH4. Karbon monoksida yang terbentuk dalam reaksi di atas kemudian digunakan untuk membentuk hidrogen tambahan dalam raeaksi berikut pada 400°C.
CO + H2O H2 + CO2
Karbon dioksida kemudian dikeluarkan dari gas bakar dengan menggunakan alkali atau amina dan kemudian di buang.
Cara lain untuk memproduksi hydrogen adalah mereaksikan uap air dengan naphtha, minyak berat atau bahkan kokas, batubara, dan batubara muda. Dalam suatu kilang minyak, sejumlah hidrogen dihasilkan dari perubahan nafta (C8H16) menjadi senyawa aromatic. Hidrogen terbentuk ketika terjadi pembentukan xylena (C8H10) :
C6H16 C8H10 + 3 H2
Hidrogen juga dapat dibentuk dalam proses uap air-besi, di mana uap air direaksikan dengan bed ferro oksida (FeO) panas (900°C). Dari reaksi ini dihasilkan besi oksida magnetik dan dan hidogen beserta panas 71 kJ/mol H2.
H2O + 3FeO Fe3O4 + H2
Bed diregeransi dengan melewatkan gas buang yang diperoleh dari pembakaran bahan bakar dengan udara yang kurang. Karbon monoksida dalam gas mereduksi Fe3O4 menjadi FeO.
Banyak penelitian telah dilaksanakan terhadap kemungkinan pembuatan hydrogen dengan apa yang disebut proses pemisahan air termokimia. Dalam proses ini air dipisah menjadi hydrogen dan oksigen dalam serangkaian siklus reaksi kimia tertutup yang beroperasi pada temperature yang berbeda. Kecuali bila terjadi lompatan kemajuan, nampaknya proses ini tidak akan kompetitif sampai bahan bakar fosil berkurang dan menjadi mahal.
Air dipecah menjadi hydrogen dan oksigen dengan radiasi ionisasi seperti di dapatkan dalam inti reactor nuklir. Cara ini tidak dipakai dalam pembuatan hidrogen karena sangat tidak efisien. Juga reaksi ini menimbulkan banyak masalah dalam operasi reactor air-ringan dan makin mengecilkan hati karena banyaknya inhibitor yang harus ditambahkan.




Comments
Post a Comment